Bilan carbone approximatif du rallye 2024 sur les circuits d’Avallon et Étaules-Ste Colombe : plus de 30 tonnes pour une seule journée
Éléments ayant servi au calcul
Pendant la course, 120 bolides sur un circuit de 40 km : 4377 kg de CO2
- Soit un total de circuits chronométrés de 40km ;
- Soit 120 voitures de compétition en surrégime, « pied au plancher », consommant chacune environ 40 litres d’essence pour 100 km ;
- Sachant que, dans des conditions de combustion idéales, un litre d’essence produit 2,28kg de dioxyde de carbone, quelle masse de dioxyde de carbone totale a été rejetée dans l’atmosphère pendant l’épreuve ?
| Nombre de voitures | Kilomètres parcourus | Litres d’essence consommés | CO2 rejeté en kg |
| Une seule | Sur 100km | 40 litres | 91,2 kg |
| Une seule | Sur 1 km | 40/100 = 0,4 litres | 0,91 kg |
| Une seule | Sur 40km | 0,4*40 = 16 litres | 36,48 kg |
| 120 voitures | Sur 40km | 120*16 = 1920 litres | 4377,6 kg |
En amont de la course, pour le transport des voitures sur plateau depuis leur lieu d’origine : environ 8570 kg de CO2
- Sachant que toutes ces voitures doivent être acheminées sur plateau depuis leur lieu d’origine, à l’aller comme au retour ;
- Sachant que, pour tirer ces voitures sur plateau, les véhicules tractant ont une consommation d’environ 20 litre pour 100 km ;
- Sachant que, dans des conditions de combustion idéales, un litre d’essence produit 2,28kg de dioxyde de carbone, quelle masse de dioxyde de carbone totale a été rejetée dans l’atmosphère pendant l’acheminement de ces voitures, en connaissant leur lieu d’origine ?
| Lieu d’origine | Distance Aller/Retour km | Nbre de concurrents | Litres d’essence consommés | CO2 rejeté en kg |
| Avallon | 4 | 49 | 39,2 | 89,38 |
| Autun | 160 | 1 | 32 | 72,96 |
| Yonne | 100 | 2 | 40 | 91,2 |
| Luronne | 294 | 1 | 58,8 | 134,06 |
| Loiret | 402 | 1 | 80,4 | 183,31 |
| Rhône | 542 | 1 | 108,4 | 247,15 |
| 91 | 418 | 2 | 167,2 | 381,22 |
| Dijon | 212 | 4 | 169,6 | 386,69 |
| Morvan | 80 | 17 | 272 | 620,16 |
| Montbéliard | 550 | 3 | 330 | 752,4 |
| 71 | 360 | 10 | 720 | 1641,6 |
| Corse | 2110 | 2 | 844 | 1924,32 |
| Jura | 408 | 11 | 897,6 | 2046,53 |
| TOTAL | 5640 | 104 | 3759,2 | 8570,98 |
Bilan carbone des spectateurs : environ 4446 kg
- Sur la base de cet article de l’Yonne Républicaine, qui parle de 1500 spectateurs ;
- En estimant qu’un quart seulement a dû prendre une voiture pour se rendre sur les lieux de l’épreuve, soit 375 voitures ;
- En estimant que le trajet moyen parcouru est d’environ 40km A/R ;
- En se basant sur une consommation moyenne d’environ 13 litres d’essence pour 100 km ;
- Sachant que, dans des conditions de combustion idéales, un litre d’essence produit 2,28kg de dioxyde de carbone, quelle masse de dioxyde de carbone totale a été rejetée dans l’atmosphère pour le déplacement du public ?
| Nombre de voitures | Kilomètres parcourus | Litres d’essence consommés | CO2 rejeté en kg |
| Une seule | Sur 100km | 13 litres | 29,64 kg |
| Une seule | Sur 1 km | 13/100 = 0,13 litres | 0,3 kg |
| Une seule | Sur 40km | 0,13*40 = 5,2 litres | 11,86 kg |
| 375 voitures | Sur 40km | 375*5,2 = 1950 litres | 4446 kg |
Bilan carbone total, en tenant compte de tous les autres déplacements liés à l’organisation : plus de 30 tonnes !
Sachant que l’organisation du rallye nécessite de nombreux déplacements supplémentaires pour :
- le repérage des circuits ;
- les réunions internes ;
- les réunions avec les représentants de l’ordre public et les collectivités concernées : mairies, sous-préfecture ;
- les commissaires de pistes et autres bénévoles ;
- les services de voirie ;
- la commission de sécurité ;
- les services de gendarmerie et de police municipale ;
- les équipes de secours....
Sachant que le bilan carbone de l’ensemble de ces déplacements est souvent largement supérieur à celui de l’épreuve... on peut lui donner un ordre de grandeur d’environ 4000 kg de CO2.
On peut dire qu’au total le rallye de l’avallonnais 2024 dépasse l’émission de 20 tonnes de carbone sur une seule journée en ne tenant compte que de la combustion de l’essence consommée.
Limites de ce bilan carbone (dont le WTT)... et autres polluants encore plus nocifs
Ce calcul carbone ne prend pas en compte :
- les déplacements des équipes en plus des voitures si ils ne se déplacent pas ensemble ;
- Le WTT ou Well to tank, ou transport de toute cette essence depuis les puits de pétrole, en passant par les raffineries : pour que l’essence arrive jusque dans le réservoir des voitures en France il faut déjà brûler pas mal d’essence pour la production et le transport du pétrole depuis le Moyen-Orient.
Par ailleurs, une étude complète devrait prendre en compte bien d’autres polluants émis...
- rejets liquides (huiles... etc) ;
- rejets gazeux, comme le monoxyde de carbone... les oxydes d’azote, puissants gaz à effet de serre très nocifs pour les êtres vivants, car la démonstration se base sur des conditions de combustion idéales... rarement réunies !
- particules fines particulièrement toxiques liées aux freinages, à l’usure des pneus et aux fortes accélérations etc...
Il conviendrait donc d’appliquer un coefficient d’ajustement d’au moins x1,5, ce qui reviendrait à 20+10 = 30 tonnes de carbone.

A titre de comparaison, cela correspond à 72 ans d’allers-retours quotidiens Avallon/Pontaubert pour un usager lambda !
Pour donner un ordre de grandeur, rapportons cela à une personne qui ferait tous les jours l’aller-retour Avallon / Pontaubert en passant par la vallée du Cousin, soit un trajet de 2*4 = 8km, avec une voiture ordinaire consommant 5litres/100 km. Combien de jours lui faudra-t-il pour atteindre les 20 tonnes de dioxyde de carbone rejetés ?
A chaque aller-retour, cette personne consomme 8/100*5 = 0,4 litres d’essence, que l’on arrondira à 0,5. Elle rejette donc tous les jours 0,5*2,28 = 1,14 kg de carbone dans l’atmosphère.
Il faudra à cette personne 20000/1,14=26315 jours, soit environ 72 ans d’allers-retours quotidiens Avallon/Pontaubert, pour franchir la barre des 30 tonnes de CO2.
Plus de 30 tonnes, est donc un beau score pour une station verte, dans une zone Natura 2000
Données théoriques
Les combustibles fossiles, une énergie non renouvelable
Les hydrocarbures (dont le pétrole) sont des combustibles fossiles. Riches en carbone, ils sont issus de la décomposition d’êtres vivants morts et enfouis dans le sol depuis plusieurs millions d’années, jusqu’à parfois 650 millions d’années.
Ces sources d’énergie ne sont pas renouvelables, parce qu’elles demandent des millions d’années pour se constituer et qu’elles sont utilisées beaucoup plus vite que le temps nécessaire pour recréer des réserves.
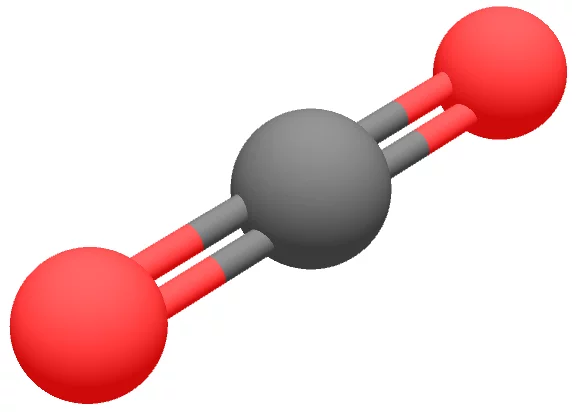
Le Dioxyde de carbone, gaz à effet de serre
En brûlant les hydrocarbures, les moteurs thermiques rejettent du dioxyde de carbone (CO2) dans l’atmosphère.
Or le CO2 est un gaz à effet de serre bien connu : il serait responsable de 26 % de l’effet de serre à l’œuvre dans notre atmosphère, aggravant le réchauffement climatique constaté à l’échelle de notre planète depuis les dernières décennies du XXe siècle.
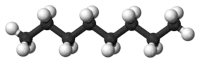
Les alcanes... et leur combustion
Pour produire de l’énergie, les moteurs thermiques « brûlent » un carburant, comme l’essence ou le gasoil, de la famille des alcanes... et rejettent, si la combustion est complète, du dioxyde de carbone (CO2 et de l’eau (H2O)) [1].
Qu’est-ce que les alcanes ? Les alcanes sont des hydrocarbures saturés. Ils ne sont constitués que d’atomes de carbone (C) et d’hydrogène (H), liés entre eux par des liaisons simples. Les atomes de carbone sont reliés à un nombre maximal d’atomes d’hydrogène — d’où le nom de « saturé ».
La formule générique d’un alcane s’écrit CnH(2n+2).
Il existe plusieurs types d’alcanes. L’essence peut être assimilée à un octane (n=8, c’est à dire 8 atomes de carbone), le gasoil à un hexadécane (n=16, c’est à dire 16 atomes de carbone).

Dans le cas d’une combustion complète (réunissant des conditions idéales), la formule générique de combustion s’écrit :
CnH(2n+2) + (3n+1)/2*O2 → nCO2 + (n+1)H2O
Données de bases : masses molaires
Pour évaluer la masse de dioxyde de carbone produite lors de la combustion des alcanes, on a besoin de connaître la masse molaire des différents éléments en jeu.
La mole est une unité de comptage (au même titre que « la douzaine » ou la « vingtaine »... etc) créée pour pour faciliter les mesures des éléments microscopiques.
Quelle quantité représente une mole ? La mole est la quantité de matière d’un système contenant autant d’entités élémentaires qu’il y a d’atomes dans 12 grammes de carbone 12. Une mole d’atomes contient environ 6,02×1023 atomes...
Cela peut paraître beaucoup ! Pour donner un ordre de grandeur, une mole de grains de maïs éclaté permettrait de recouvrir la surface des États-Unis d’une couche uniforme d’une épaisseur d’environ 14 km !
Mais quand on mesure des éléments microscopiques, on comprend mieux l’intérêt d’une mole. En effet, imaginez un peu que l’on s’amuse à mesurer la masse d’un seul atome ou d’une seule molécule ? Surtout lorsque l’on veut des mesures en grammes !
La masse molaire consiste donc à mesurer la masse d’une mole d’atomes ou de molécules d’un élément donné. Comme si, au lieu de peser des œufs à l’unité, on les pesait par douzaines.
| Substance | Formule | Masse molaire |
| Carbone | C | 12g/mol |
| Oxygène | O | 16g/mol |
| Hydrogène | H | 1g/mol |
| Azote | N | 14g/mol |
| Dioxyde de carbone | CO2 | 12 + 2*16 = 44 g/mol |
| Eau | H2O | 2 x 1 + 16 = 18g/mol |
| Diazote | N2 | 2 x 14 = 28g/mol |
| Carburant | Alcane | Formule | Masse molaire |
| Essence | Octane | C8H18 | 8*12 + 18*1 = 114g/mol |
| Gasoil | Hexadécane | C16H34 | 16*12 + 34*1 = 226g/mol |
Rejets de CO2 dans le cas de l’essence
La formule simplifiée de la réaction de combustion complète de l’octane est :
C8H18 + 25/2 O2 → 8 CO2 + 9 H2O,
ou avec des nombres entiers :
2C8H18 + 25 O2 → 16 CO2 + 18 H2O
| Gaz rejeté | Masse de gaz rejetée en grammes |
| CO2 | 8*44 = 352g |
| H2O | 9*18 = 162g |
Donc la combustion de 114g d’essence génère 352g de CO2. Le rapport de CO2 émis en fonction de la consommation d’essence est de 352/114 = 3,09. Autrement dit, la combustion d’1 gramme d’essence génère 3,09 g de CO2.
Mais l’essence se mesure communément en litres... Sachant que la masse volumique de l’essence est de 0,74 kg/litre, la combustion d’1 litre d’essence produit 0,74*3,09 = 2,28 kg de CO2.
| Volume essence | Masse d’essence | Masse de CO2 rejetée |
| 1,35 litres | 1 kg | 3,09 kg |
| 1 litre | 0,74 kg | 0,74*3,09 = 2,28kg |

